При повышенной температуре кислород реагирует со всеми веществами

Кислород – самый распространенный химический элемент на планете. Его массовая доля в земной коре составляет 47,3%, объемная доля в атмосфере – 20,95%, а массовая доля в живых организмах – около 65%. Что представляет из себя этот газ, и какими физическими и химическими свойствами кислород обладает?

Кислород: общая информация
Кислород – неметалл, в нормальных условиях не имеющий цвета, вкуса и запаха.

Рис. 1. Формула кислорода.
Практически во всех соединениях, кроме соединений с фтором и пероксидов, он проявляет постоянную валентность II и степень окисления -2. Атом кислорода не имеет возбужденных состояний, так как на втором внешнем уровне нет свободных орбиталей. Как простое вещество кислород существует в виде двух аллотропных видоизменений – газов кислорода O2 и озона O3.
при определенных условиях кислород может находится в жидком или твердом состоянии. они в отличие от газа имеют цвет: жидкий – светло-голубого цвета, а твердый кислород имеет светло-синий оттенок.

Рис. 2. Твердый кислород.
Кислород в промышленности получают с помощью сжижения воздуха с последующим отделением азота за счет его испарения (имеется разница в температурах кипения: -183 градуса для жидкого кислорода и -196 градусов для жидкого азота).
Химические свойства взаимодействия кислорода
Кислород является активным неметаллом. Кислород способен вступать в реакцию со всеми элементами кроме неона, гелия и аргона. обычно реакции этого газа с другими веществами экзотермичны. Процесс окисления, идущий при одновременном выделении энергии в виде тепла и света, называется горением. Очень важно использование органических соединений, в частности, алканов, в качестве топлива, так как при свободно-радикальной реакции горения выделяется большое количество тепла:
CH4 +2O2 = CO2 +2H2O +880 кДж.
С неметаллами кислород обычно вступает в реакцию при нагревании, образуя при этом оксид. Так, реакция с азотом начинается лишь при температуре выше 1200 градусов или в электрическом разряде:
N2 + O2 =2NO.
Кислород также реагирует с металлами:
3Fe + 2O2= Fe3O4 (в результате реакции образуется соединение – оксид железа)
в природе существует еще более сильный окислитель, чем кислород, это – озон. Он способен окислять золото и платину. В естественных условиях озон образуется из кислорода воздуха во время грозовых разрядов, а в лаборатории – пропусканием электрического разряда через кислород: 3О2 = 2О3 – 285 кДж (эндотермическая реакция)

Рис. 3. Озон.
Самое значительное соединение кислорода – вода. Около 71% земной поверхности занимает водная оболочка. Угловые молекулы воды полярны, каждая из них образует четыре водородные связи: две – как донор протонов и две – как акцептор протонов. Образуются ассоциаты (H2O)x, где x меняется от 2 до 5. В водяном паре присутствуют димеры (H2O)2, а в конденсированных фазах молекула воды может находиться в тетраэдрическом окружении четырех других молекул. если бы молекулы воды не были ассоциированы, то ее температура кипения составляла бы не 100 градусов, а около 80 градусов.
Что мы узнали?
Кислород – сильный окислитель и активный неметалл, поэтому его изучение начинается уже в 8 классе. Он является бесцветным газом без запаха, но также при определенных условиях может находится в жидком и твердом состояниях. Он взаимодействует с металлами и неметаллами, образуя оксиды, а также реагирует с большинством простых веществ.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
-
Людмила Холина
10/10
Марина Островская
8/10
Регина Сычёва
7/10
Алексей Муркелинский
10/10
Оценка доклада
Средняя оценка: 4.5. Всего получено оценок: 531.
Источник
Химические свойства кислорода. Оксиды. Применение. Круговорот кислорода в природе
Данный урок посвящен изучению химических свойств простого вещества кислорода. Из материалов урока вы узнаете, на каких свойствах кислорода основано его применение в металлургии, медицине, пищевой промышленности и других областях.
I. Химические свойства кислорода
Кислород энергично реагирует со многими веществами: простыми – металлами и неметаллами и сложными.
Химические реакции взаимодействия веществ с кислородом называются реакциями окисления.
Химическая реакция, при которой происходит окисление веществ с выделением тепла и света называется реакцией горения.
Продуктами реакций взаимодействия веществ с кислородом, в большинстве случаев, являются оксиды.
Оксиды – это сложные вещества, которые состоят из двух элементов, одним из которых является кислород.
Общая формула оксидов: ЭхОу , где Э – это химический элемент в валентности = Nгруппы(для элементов главных подгрупп «А»), О – это кислород в валентности (II), Х и У – это индексы, полученные исходя из валентностей элемента.
1. С большинством металлов кислород реагирует уже при комнатной температуре, образуя оксиды.
- Железо сгорает в кислороде при температуре с треском и разбрасыванием искр, при этом образуется железная окалина Fe3O4 – это соединение двух оксидов железа: FeOв валентности (II) и Fe2O3в валентности (III):
3Fe + 2O2 = FeO· Fe2O3(железная окалина Fe3O4)
- А вот медь не горит в кислороде, а окисляется кислородом при нагревании. При этом образуется оксид меди (II): 2Cu + O2 = 2CuO
- Взаимодействия кислорода с магнием.
Видео – эксперимент: “Взаимодействие кислорода с магнием”
В атмосфере кислорода магний вспыхивает ослепительным белым пламенем.При горении магния выделяются ультрафиолетовые лучи. 2Mg + O2= 2MgO
2. С неметаллами (за исключением гелия, неона, аргона) кислород реагирует, как правило, при нагревании. Так, с фосфором он реагирует при температуре ~ 60 °С, образуя Р2О5, с серой – при температуре около 250 °С.
- Взаимодействие с серой: S + О2 = SO2
В чистом кислороде сера сгорает быстрее, чем на воздухе.
- С графитом кислород реагирует при 700 °С: С + О2 = СО2.
Если сжечь уголь в сосуде с кислородом, то в этом случае уголь сгорит быстрее, чем на воздухе. То есть, скорость горения угля в кислороде выше, чем на воздухе.
- Взаимодействие кислорода с азотом начинается лишь при 1200 ° С или в электрическом разряде: N2 + О2= 2NО
- Горение фосфора в кислороде: 4P + 5O2 = 2P2O5
3. Кислород реагирует и со многими сложными соединениями, например с оксидом азота (II) он реагирует уже при комнатной температуре: 2NО + О2 = 2NО2
Сероводород, реагируя с кислородом при нагревании, дает серу: 2Н2S + О2 = 2S+ 2Н2О
или оксид серы (IV): 2Н2S + ЗО2 = 2SО2 + 2Н2О в зависимости от соотношения между кислородом и сероводородом.
Алгоритм составления реакций взаимодействия веществ с кислородом
II. Применение кислорода
Применение любого вещества связано с его свойствами. Так и применение кислорода обусловлено, в основном, его способностями поддерживать дыхание и обеспечивать горение.
Рассмотрим основные области применения кислорода.
1. В металлургии, для резки и сварки металлов
Кислород используют в металлургии при производстве стали. Также, во многих металлургических агрегатах для более эффективного сжигания топлива вместо воздуха в горелках используют кислородо-воздушную смесь, т.е. обогащают воздух кислородом.
Рис. 1. Производство стали
Кислород в баллонах широко используется для газопламенной резки и сварки металлов. Горючий газ ацетилен, сгорая в токе кислорода, позволяет получить температуру выше 3000°С! Это приблизительно вдвое больше температуры плавления железа.
2. Окислитель топлива
Кислород, входящий в состав воздуха, применяют для сжигания топлива: например, в двигателях автомобилей, тепловозов и теплоходов.
В качестве окислителя для ракетного топлива применяется жидкий кислород. Смесь жидкого кислорода и жидкого озона — один из самых мощных окислителей ракетного топлива.
3. Применение в медицинских целях
В медицине кислород тоже нашел свое применение. Кислород используется для обогащения дыхательных газовых смесей при нарушении дыхания, для лечения астмы, профилактики гипоксии в виде кислородных коктейлей, кислородных подушек. Однако чистым кислородом при нормальном давлении долго дышать нельзя – это опасно для здоровья.
4. Применение в пищевой промышленности
В пищевой промышленности кислород зарегистрирован в качестве пищевой добавки E948, как пропеллент и упаковочный газ. Пропелленты — газы, выдавливающие пищевые продукты из ёмкости (контейнера, баллончика со спреем, танка или хранилища для сыпучих продуктов).
5. Биологическая роль
Кислород выполняет бесценную биологическую роль.
Кислород необходим практически всем живым существам для дыхания. Дыхание – это окислительно-восстановительный процесс, где кислород является окислителем. С помощью дыхания живые существа вырабатывают энергию, необходимую для поддержания жизни.
III. Круговорт кислорода в природе
В природе кислород образуется в процессе фотосинтеза, который происходит в зелёных растениях на свету. В целях сохранения кислорода в воздухе вокруг городов и крупных промышленных центров создаются зоны зелёных насаждений.
10 удивительных фактов о кислороде, которые должен знать каждый
Наша планета поддерживает жизнь благодаря наличию воды, атмосферы и ее защитных слоев. Земля могла бы быть каменной пустыней, если бы не кислород — элемент, питающий жизнь на нашей планете. Вот интересные факты о газе, который содержится в нашей атмосфере в количестве 21 % ее объема.
1. Кислород не горит
Как ни удивительно, это чистая правда. Кислород способствует горению других элементов, но не горит сам. И хорошо, ведь если бы это было не так, одной горящей, спички было бы достаточно, чтобы сжечь весь кислород в атмосфере нашей планеты.
2. Кислород хорошо растворяется
Он растворяется в воде почти в два раза лучше, чем азот. Если бы у этого элемента была такая же растворимость, как у азота, в морях, озерах и реках было бы намного меньше кислорода, что сделало бы жизнь намного труднее для огромного количества живых организмов.
3. Вес кислорода
Этот газ отвечает за почти две трети веса большинства живых организмов, главным образом потому, что живые существа состоят из большого количества воды, а 88,9 % веса воды составляет кислород.
4. Нестабильный газ
Кислород (O) нестабилен в атмосфере нашей планеты и регулярно исчезает, поэтому его запас должен постоянно пополняться фотосинтезом. Без растительности и водорослей наша атмосфера почти не содержала бы O.
Кстати, говоря о водорослях, зеленые морские водоросли обеспечивают приблизительно 70 % кислорода, произведенного на Земле посредством фотосинтеза, остальные 30 % произведены оставшимися зелеными растениями.
5. Инопланетная жизнь
Если мы обнаружим какие-либо другие планеты с атмосферами, богатыми кислородом, можно быть практически уверенными, что на этих планетах присутствует жизнь. Значительное количество O наблюдается только там, где оно может пополняться живыми организмами.
6. Земная кора
Всего пять химических элементов составляют более 90 % веса земной коры. Почти половина этого веса — кислород. Кремний, алюминий, железо и кальций — оставшиеся элементы.
7. Холод
Мировые океаны содержат немало растворенного в воде кислорода, который поддерживает жизнь. Полярные океаны, будучи самыми холодными, содержат больше растворенного кислорода и поэтому поддерживают огромное количество живых организмов.
8. Озон
Озон (O3) – аллотропная форма кислорода, которая реагирует лучше, чем обычный кислород. Озон выделяется в природе во время крупных электрических выбросов (штормы и грозы с молниями) или ультрафиолетовым излучением в верхних слоях атмосферы Земли. Озон действует как защитный слой, предохраняющий нас от вредного воздействия ультрафиолетовых лучей. Иногда озон вместо хлора используется в обработке питьевой воды.
9. Вода
Вода (H2O) является самой широко известной молекулой, содержащей кислород. Другие известные молекулы являются оксидами, например, оксид железа, или ржавчина (Fe2O3), углекислый газ (CO2), окись алюминия (Al2O3) и кварц (SiO2).
10. Яд или афродизиак?
Слишком большое количество кислорода может оказаться токсичным. Это опасно во время подводного плавания, когда в легкие попадает большее количество О, чем обычно.
Кроме того, кислород, по мнению многих, вызывает состояние эйфории, но его воображаемые эффекты на спортивных состязаниях не доказаны с медицинской точки зрения.
IV. Выполните тест
V. Лабиринт “Кислород”
VI. Кроссворд
ЦОРы
Видео: “Горение магния в кислороде”
Видео-презентация:“Круговорот кислорода в природе”
Видео: “Горение фосфора в кислороде”
Домашнее задание
- Параграф 23,24
- Стр. 80 упр. 5-7 (письменно)
- Выполните тест
- ИДЗ
Источник
Скорость химической реакции зависит от
природы реагирующих веществ.
Металлы с одним и тем же веществом —
водой — реагируют с различными скоростями.
Литий энергично реагирует с водой с выделением
водорода и образованием щелочи — гидроксида
лития.
Калий реагирует со взрывом и горит фиолетовым
пламенем на поверхности воды.
Цинк бурно реагирует с соляной кислотой, а
железо довольно медленно.
Фтор с водородом реагирует со взрывом при
комнатной температуре:
Бром с водородом взаимодействует медленно и
при нагревании:
Для веществ в растворенном состоянии и
газов скорость химических реакций зависит от
концентрации реагирующих веществ.
1. Горение веществ в чистом кислороде происхо-
дит интенсивнее, чем в воздухе, где концентрация
кислорода почти в пять раз меньше.
2. При реакции цинка с раствором серной кис-
лоты большей концентрации, скорость выделения
водорода выше.
Это объясняется тем, что для осуществления
химического взаимодействия веществ А и 5, их мо-
лекулы (частицы) должны столкнуться. Чем больше
столкновений, тем быстрее протекает реакция. От-
сюда сформулирован основной закон химической
кинетики: скорость химической реакции пропор-
циональна произведению концентраций реагирую-
щих веществ. Зависимость скорости химической
реакции от концентрации реагирующих веществ
справедлива для газов и реакций, протекающих в
растворах, так как при реакции с участием твердых
веществ в этих случаях взаимодействие молекул
происходит не во всем объеме реагирующих ве-
ществ, а лишь на поверхности.
Для веществ в твердом состоянии скорость
реакции прямо пропорциональна поверхности
реагирующих веществ.
1. Вещества железо и сера в твердом состоянии
реагируют достаточно быстро лишь при предвари-
тельном измельчении и перемешивании.
2. Взаимодействие соляной кислоты с Zn, в виде
гранул происходит медленнее, чем в виде порошка
3. Уголь в виде больших кусков сгорает в печи
медленнее, чем измельченный
Чем сильнее измельчено твердое вещество, тем
больше его поверхность, а значит, скорость реакции
выше.
При повышении температуры на каждые
10°С скорость большинства реакций увеличивается в 2—4 раза.
1. Со многими веществами кислород начина-
ет реагировать с заметной скоростью уже при
обыкновенной температуре. При повышении темпе-
ратуры начинается горение. Медь при нагревании
в кислороде (и на воздухе) не горит, а «спокойно»
превращается в черный порошок оксида меди:
Железо горит в чистом кислороде, разбрасывая
в виде ярких искр частички раскаленной железной
окалины:
2. Водород восстанавливает оксиды металлов
при нагревании, при комнатной температуре эта
реакция не идет.
3. Взаимодействие оксида меди (II) с соляной
кислотой происходит как при комнатной температу-
ре, так и при нагревании, однако во втором случае
реакция протекает быстрее:
Скорость химических реакций зависит от
наличия катализаторов.
1. Разложение бертолетовой соли и пероксида
водорода ускоряется в присутствии катализатора
оксида марганца (IV):
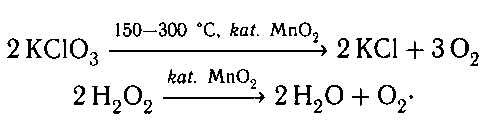
Окисление оксида серы (IV) в оксид серы (VI)
ускоряется оксидом ванадия (V).
2. С водородом Mg непосредственно не взаимо-
действует, но при наличии катализатора и повышен-
ных температур такое взаимодействие возможно:
3. Реакция конверсии оксида углерода необхо-
дима в промышленности и протекает по реакции:
При этом смещение равновесия вправо осу-
ществляется катализатором и повышенной темпе-
ратурой.
Ферменты — природные катализаторы. Участ-
вуют практически во всех биохимических реакциях,
протекающих в живых организмах.
Источник
Кислород (лат. Oxygenium) – элемент VIa группы 2 периода периодической таблицы Д.И. Менделеева. Первым открывает
группу халькогенов – элементов VIa группы.
Газ без цвета, без запаха, составляет 21% воздуха.

Общая характеристика элементов VIa группы
Общее название элементов VIa группы O, S, Se, Te, Po – халькогены. Халькогены (греч. χαλκος – руда + γενος –
рождающий) – входят в состав многих минералов. Например, кислород составляет 50% массы земной коры.
От O к Po (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств.
Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Среди элементов VIa группы O, S, Se – неметаллы. Te, Po – металлы.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np4:
- O – 2s22p4
- S – 3s23p4
- Se – 4s24p4
- Te – 5s25p4
- Po – 6s26p4
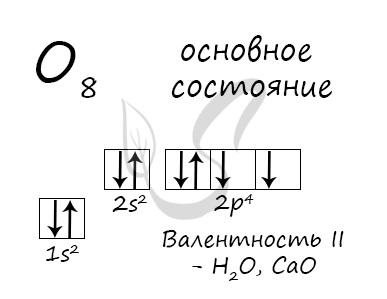
Основное состояние атома кислорода
У атома кислорода (как и атомы азота, фтора, неона) нет возбужденного состояния, так как отсутствует свободная орбиталь с более
высоким энергетическим уровнем, куда могли бы перемещаться валентные электроны.
Атом кислорода имеется два неспаренных электрона, максимальная валентность II.
Природные соединения
- Воздух – в составе воздуха кислород занимает 21% (это число пригодится в задачах!)
- В форме различных минералов в земной коре кислорода содержится около 50%
- В живых организмов кислород входит в состав органических веществ: белков, жиров, углеводов и нуклеиновых кислот
Получение
В промышленности кислород получают из сжиженного воздуха. Также активно применяются кислородные установки, мембрана которых
устроена как фильтр, отсеивающие кислород (мембранная технология).
В лаборатории кислород получают разложением перманганата калия (марганцовки) или бертолетовой соли при нагревании. Применяется реакция
каталитического разложения пероксида водорода.
KMnO4 → K2MnO4 + MnO2 + O2↑
KClO3 → KCl + O2↑
H2O2 → (кат. – MnO2) H2O + O2
На подводных лодках для получения кислорода применяют следующую реакцию:
Na2O2 + CO2 → Na2CO3 + O2↑

Химические свойства
Является самым активным неметаллом после фтора, образует бинарные соединения со всеми элементами кроме гелия, неона, аргона. Чаще всего реакции
с кислородом экзотермичны (горение), ускоряются при повышении температуры.
- Реакции с неметаллами
- Реакции с металлами
- Горение воды
- Окисление органических веществ
- Контролируемое окисление
Во всех реакциях, кроме взаимодействия со фтором, кислород проявляет себя в качестве окислителя.
NO + O2 → (t) NO2
S + O2 → (t) SO2
2C + O2 = (t) 2CO (неполное окисление – угарный газ, соотношение 2:1)
C + O2 = (t) CO2 (полное окисление – углекислый газ, соотношение 1:1)
F + O2 → OF2 (фторид кислорода, O+2)
В реакциях кислорода с металлами образуются оксиды, пероксиды и супероксиды. Реакции с активными металлами идут без нагревания.
Li + O2 → Li2O (оксид)
Na + O2 → Na2O2 (пероксид)
K + O2 → KO2 (супероксид)
Известна реакция горения воды во фторе.
F2 + H2O → HF + O2

Все органические вещества сгорают с образованием углекислого газа и воды.
C3H7 + O2 = CO2 + H2O

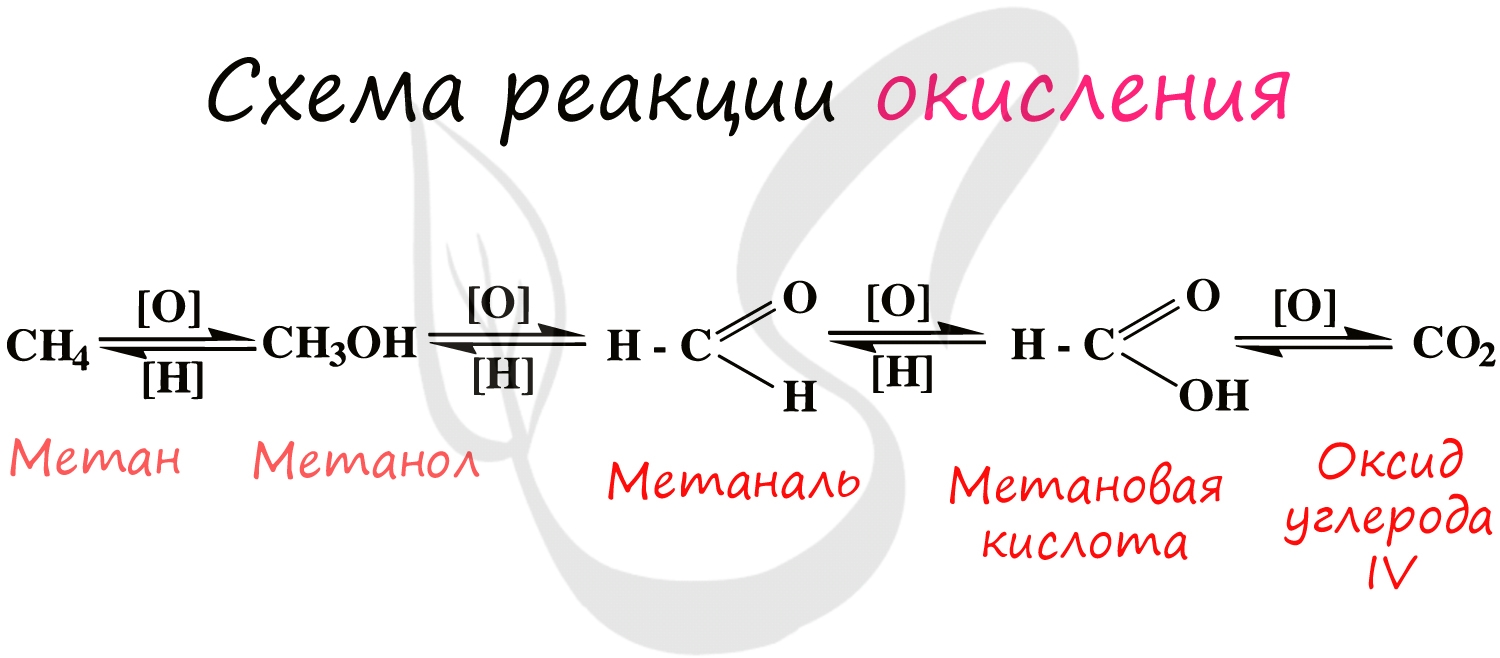
При применении катализаторов и особых реагентов в органической химии достигают контролируемого окисления: алканы окисляются
до спиртов, спирты – до альдегидов, альдегиды – до кислот.
Процесс можно остановить на любой стадии в зависимости от желаемого результата.
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
