Температура денатурации белка человека

379 просмотров
16 марта 2019
Здравствуйте! Ребенку 9 лет, заметила перед тем как заболеть начинает шмыгать носом, пытается отсморкаться, для меня это признак начала заболевания. В этот раз также вечером зашмыгал, в 5 утра -рвота, поила регидроном, повысилась температура к вечеру 38,8 на ночь дала ибуклин.
Теперь уже поняла, как только даю нурофен или ибуклин у ребенка галлюцинации часа через два после приема. Что делать не знаю, температура опять 38, 8 кожа бледная, давать таблетки – собственными руками травлю ребенка… Посоветуйте с проф.точки зрения, чем лечить, у сына были судороги ранее, ставили эпи, потом эписиндром. Заранее, спасибо
На сервисе СпросиВрача доступна бесплатная консультация педиатра онлайн по любой волнующей Вас проблеме. Врачи-эксперты оказывают консультации круглосуточно. Задайте свой вопрос и получите ответ сразу же!
Педиатр
Здравствуйте, в отделение срочно!
Педиатр
Здравствуйте! Сбивайте литической смесью и не давайте температуре поввшаться до таких цифр(начинайте сбивать при температуре тела 37.5-38 градусов). Лучше вызвать Скорую помощь.
Гематолог, Терапевт
Здравствуйте , это серьезные вещи вы описываете, сначала ЭЭГ, МРТ , осмотр невролога, только потом думать и решать что и как делать. Температуру ниже 38 принормальном соматическом статусе можно не сбивать. Обильное питье, увлажнение слизистых, гриппферон в нос
Акушер, Гинеколог
Здравствуйте, если у ребёнка были судороги ранее и эписиндром, то не нужно ждать до 38,5 чтобы сбивать температуру, если уже такая высокая температура поднялась, то езжайте в больницу или вызывайте скорую
Акушер, Гинеколог, Детский гинеколог
Здравствуйте.
Не занимайтесь самолечением!
Обратитесь в дежурный стационар, снижать будут литической смесью и возьмут все необходимые анализы сразу.
Педиатр
По скорой в стационар, там пролечитесь потом обязательно у невролога обследование полное, желательно в условиях дневного стац чтобы все сразу назначили.
Педиатр
Здравствуйте если в анамнезе судороги,то не стоит дожидаться температуры выше 37,5
Вызовите скорую
Педиатр
Здравствуйте! Отпаивйте регидроном при повышении температуры. Там и снятие лихорадки и электролиты.
Педиатр
Давайте в сезон простуд циклоферон по 3
таб по схеме за 1прием за 30мин до еды. А дальнейшем по 2 р в неделю.
Андролог, Уролог
Либо вы преувеличиваете в описании либо вам срочно необходимо обратиться по неотложной помощи в детскую больницу. Советую лучше обратиться. На расстоянии не оценить.
Терапевт, Нефролог
Белая лихорадка,встречается у детей с особой вегетатикой. В этом случае вместе с жаропонижающими давать спазмолитики и не ждать,когда на градуснике будет 38,5. У таких детей озноб появляется гораздо раньше и можно уже давать препараты.
Гинеколог, Кардиолог, Венеролог
Срочно вызывайте скорую вам сделают литическую смесь. Вероятно госпитализируют
Педиатр
Дайте Парацетамол в возрастной дозировке.
Денатурация белка вашему ребенку не грозит.
Педиатр
Учитывая, что были судороги, то температуру начинаете сбивать около 38 град, и лучше это Ибупрофен или парацетамол, не используйте у детей ибуклин дозировка большая и комбинированный препарат, очень легко передозировать и не определить на какой компонент реакция. И обязательно отпаивать ребенка
Оцените, насколько были полезны ответы врачей
Проголосовало 0 человек,
средняя оценка 0
Что делать, если я не нашел ответ на свой вопрос?
Если у Вас похожий или аналогичный вопрос, но Вы не нашли на него ответ – получите свою 03 онлайн консультацию от врача эксперта.
Если Вы хотите получить более подробную консультацию врача и решить проблему быстро и индивидуально – задайте платный вопрос в приватном личном сообщении. Будьте здоровы!
Источник
Всем известно, что 36,6 °C – это нормальная температура тела, а 39 °C означает, что все очень плохо. Но при этом вы когда-нибудь задумывались, что произойдет, если ваш градусник вдруг покажет цифры за пределами этих значений?
Мы в AdMe.ru всерьез задались этим вопросом и нашли результат, который стоило бы знать каждому. Давайте рассмотрим запредельные температуры и выясним, почему же они нигде не упоминаются.
Нормальная температура – 35,5–37 °C
В течение дня температура тела каждого из нас колеблется в пределах от 35,5 °C (утром) до 37,0 °C (вечером). Такое изменение температуры определяется суточным циклом Солнца, непосредственно вы на процесс особо не влияете. Вдобавок вот вам интересный факт: средняя температура тела женщин на 0,5 °C выше, чем у мужчин.
Длительные 37,1–38,0 °C
Повышенная температура в пределах 37,1–38,0 °C в течение длительного времени может говорить о наличии некоего вялотекущего заболевания в организме. В некоторых случаях такая температура может быть единственным проявлением какой-либо болезни на ранних стадиях, поэтому лучше сразу обратиться к врачу.
Если же подобная температура наблюдается в течение короткого времени, паниковать вовсе не стоит, это неопасно.
Высокие 38–41°C
Такой подъем температуры воспринимается нами как ужасная болезнь. Но на самом деле температура 39 °C и выше затормаживает размножение абсолютного большинства микробов. Благодаря этому процессы в иммунной системе протекают быстрее, интенсифицируется кровоток, сокращается срок выделения антител против вашего вируса. При этом зачастую включается программа мелкой мышечной дрожи, что удерживает тепло внутри. Если у вас в таком состоянии возникает жар, это говорит о второй фазе – снижении температуры. Так что высокая температура – это автоматизированная борьба организма за выживание. Это вовсе не плохо. Но и бездействовать тоже нельзя – смотрим следующий пункт.
Также температура может подниматься до 40 °C в парной бане – в этом случае не стоит беспокоиться, это естественно.
Экстремальные 42–43 °C
Вы никогда не задумывались, почему шкала медицинского градусника заканчивается на 45 °C? Дело в том, что при 42 °C начинается необратимое разложение белков в организме, при 43 °C – денатурация белков в нейронах головного мозга, что ведет к гарантированному летальному исходу. Поэтому температуру выше 40 °C нужно немедленно сбивать.
Опасные 30–35 °C
Уровень температуры от 30 до 35 °C указывает либо на сильное переутомление, либо на наличие серьезного заболевания. Даже при минимальном падении температуры тела ниже нормы человека начинает знобить (мышцы пытаются выработать больше тепла), сжимаются кровеносные сосуды. От 33 °C начинают замедляться обменные процессы организма.
Катастрофичные 29,5 °C
При данной температуре падает насыщение организма кислородом, замедляется кровоснабжение. Большинство людей в таком состоянии теряют сознание.
И последние 26,5 °C
Ниже 26,5 °C кровь начинает сворачиваться и образовывать тромбы. Это препятствует притоку крови к жизненно важным органам и также вызывает летальный исход.
Оговорка: бывают исключения. Например, рекорд был зафиксирован в 1994 году, когда у 2-летней канадской девочки, проведшей 6 часов на морозе, температура тела равнялась 14,2 °C (сейчас с ней все хорошо). Но это единичный случай, скорее, даже феноменальный. Так что при понижении температуры лучше сразу обратиться к врачу.
А у вас когда-нибудь была аномальная температура?
Источник

Денатурация (от латинского – Denaturare – лишать природных свойств) – процесс, который сопровождается глубокими деструктивными изменениями в молекулах биополимеров, чаще всего белков. Данный процесс связан с нарушением третичной, четвертичной и вторичной структур, вызывает в свою очередь изменения как физических, так и биологических и химических свойств белка. Процесс денатурации белков происходит под влиянием химических (органические и минеральные кислоты, органические растворители, щелочи, алкалоиды, тяжелые металлы, детергенты, а также некоторые амиды, например, мочевина и др.) и физических (ультразвук, температура, ионизирующая радиация и др.) факторов. Обратный данному процессу – ренатурация.
Что происходит в процессе денатурации белков?
В процессе денатурации белка имеет место разрыв химических связей (дисульфидных, водородных, ван-дер-ваальсовых, электростатических и др.), которые стабилизируют высшие уровни организации белковой молекулы, что обуславливает изменение пространственной структуры белка. Следует отметить, то в большинстве случаев первичная структура белка в процессе денатурации не нарушается, поэтому после раскрутки цепи полипептидов (стадия нити), протеин может снова стихийно скручиваться, при этом образуя «случайный клубок», то есть переходит к хаотическому состоянию, отличного от нативной конформации.
Процесс денатруации белков происходит при температуре выше, чем 56 °С.
Типичными признаками необратимой денатурации белков является снижение гидрофильности и растворимости белков, увеличение оптической активности, изменение изоэлектрической точки, уменьшение устойчивости белковых растворов и молекулярной массы и изменение формы белковых молекул, увеличение вязкости и усиление способности к расщеплению ферментами, переход молекулы в хаотическое состояние, при котором наблюдается агрегация частиц белка и выпадение их в осадок.
Схема денатурации белка: а – нативная молекула; б – развертывание полипептидной цепи; в – стадия нити; г – случайный клубок
При непродолжительном действии денатурирующего агента (например, органического растворителя) возможно восстановление нативной структуры белка. Этот процесс называется ренатурацией. При ренатурации происходит восстанавлениене только структуры, но и биологических функций белка. С денатурацией связаны процессы переработки продуктов питания, изготовления одежды, обуви, консервирования и сушки овощей и фруктов. Результатом необратимой денатурацией протеинов является потеря способности к прорастанию семян при длительном хранении, особенно при неблагоприятных условиях. Процесс денатурации белков широко применяется в медицине, ветеринарии, фармации, клинике и биохимических исследованиях с целью осаждения протеина в биологическом материале с целью дальнейшей идентификации в нем низкомолекулярных и небелковых субстанций, с целью как установления наличия протеина, так и его количественного определения, для обеззараживания слизистых покровов и кожи, для конъюгации солей тяжелых металлов при терапии отравлений солями свинца, ртути, меди и т.п. или с целью профилактики подобных токсикозов на предприятии.
Процесс денатурации белков происходит также при приеме фармакологических препаратов танальбина и танина, на чем базируются их противовоспалительное и вяжущее действие. Вяжущие свойства танина базируются на его способности осаждать протеины с синтезом плотных альбуминатов, защищающих от раздражения тканей, в частности чувствительные нервные окончания. При этом уменьшается проявление воспалительной реакции, а также снижаются болевые ощущения и происходит непосредственное уплотнение мембран клеток. Препарат танальбин представляет собой продукт взаимодействия белка казеина с танином – в отличие от танина, данный препарат не оказывает вяжущего действия на слизистую оболочку желудка и ротовой полости. Только после попадания в кишечник он поддается процессу расщепления, выделяя при этом свободный танин. Применяется в медицине и ветеринарии как вяжущее лекарственное средство при хронических и острых болезнях кишечника, в частности у детей.
В практике фармацевтики использование процессов денатурации белка дает возможность контролировать качество протеиновых препаратов, например, в ампулах.
^Наверх
Полезно знать
- Аэросил – диоксид кремния
- Аутоантитела и аутоиммунный ответ
- Аналитическая проба
Источник
ДЕНАТУРАЦИЯ — существенные изменения природных свойств вещества под влиянием химических или физических воздействий. Термин «денатурация» применяется обычно к белкам (см.). Нарушение нативной уникальной структуры под влиянием повышения температуры, высокого гидростатического давления, ультразвука, ионизирующих излучений, резких сдвигов pH, добавления некоторых химических веществ, разрывающих нековалентные связи (напр., мочевины, солей гуанидина, трифторуксусной или трихлоруксусной к-т), называется общим термином «денатурация белков». Молекуле нативного белка свойственна внутренняя упорядоченность, поддерживаемая системой нековалентных связей между многочисленными структурными элементами. При Денатурации такая упорядоченность нарушается. Ковалентные (химические) связи в молекуле белка при Денатурации не затрагиваются, и первичная структура белка сохраняется. Структуры высоких порядков — вторичная или третичная — нарушаются полностью или в значительной степени. Изменение нативного состояния молекул, аналогичное Денатурации белков, известно также и для нуклеиновых кислот (см.).
Биологически активные белки — ферменты, антитела и др.— при Д. инактивируются. Причиной этого является то, что в процессе Д. нарушаются активные центры — точно организованные участки белковых молекул, непосредственно ответственные за соответствующую биол, функцию. Физ.-хим. изменения, сопровождающие Д., также связаны с нарушением упорядоченной структуры белка. Так, при Д. нарушаются (в различной степени) спирализованные участки полипептидной цепи, что фиксируется соответствующими спектрополяриметрическими сдвигами. Переход полипептидной цепи белка из плотно упакованного в беспорядочное и подвижное состояние вызывает изменение вязкости и других гидродинамических свойств их р-ров. В состоянии Д., когда полипептидная цепь становится более подвижной, общая реактивность хим. групп увеличивается. Нетитрующиеся (т. е. не вступающие в реакцию) сульфгидрильные (SH-) и некоторые другие группы, присутствующие во многих нативных белках, обычно титруются после Д. Взаимодействие белков с нек-рыми красителями резко усиливается в результате Д. Из-за повышения доступности и увеличения реактивности различных хим. групп при Д. очень сильно возрастает степень взаимодействия между отдельными белковыми молекулами. В денатурированном состоянии белки легко агрегируют, т. е. денатурированные белки легко осаждаются, свертываются или же латинизируются. Для сохранения белка в растворенном состоянии после Д. приходится применять солюбилизирующие вещества — детергенты (см.), мочевину и др.
Д. белков обычно сопровождается значительным увеличением теплосодержания и энтропии (см. Термодинамика), хотя эти изменения зависят от условий среды. В простейших случаях система при Д., по-видимому, содержит всего две формы белка — нативную и полностью денатурированную. По мере Д. белок переходит из одной формы в другую без заметного образования каких-либо промежуточных форм и, следовательно, весь денатурационный переход белковой молекулы протекает как единый скачок. В других случаях кинетика денатурации указывает на образование в ходе реакции нескольких относительно стабильных не нативных форм белка, что соответствует более сложной схеме перехода. Но если при Д. молекула белка претерпевает несколько конформационных превращений, то каждое из них является кооперативным, т. е. включает большое число взаимозависимых реакций, заключающихся в образовании и разрыве нековалентных связей.
В прошлом Д. рассматривали как необратимый процесс, как переход белка в состояние, имеющее минимальный уровень свободной энергии. Теперь хорошо известно, что Д. обратима. Фактически наступающая необратимость создается, как оказалось, сопутствующими реакциями — агрегацией белка, окислением SH-групп с образованием новых дисульфидных (S—S) связей и пр. Если эти реакции в достаточной мере исключены, то тенденция к возвращению белка в нативное состояние (ренатурация) проявляет себя сразу же по прекращении действия денатурирующего агента.
Если Д. по существу представляет собой физ. переход упорядоченность — беспорядок, то в ренатурации ярко проявляется биол, особенность белков — способность к самоорганизации, путь к-рой определен строением полипептидной цепи, т. е. наследственной информацией. В условиях живой клетки данная информация, вероятно, является решающей для преобразования беспорядочной полипептидной цепи во время или после ее биосинтеза на рибосоме в нативную молекулу белка.
Библиография: Белицер В. А. Макроструктура и денатурационные превращения белков, Укр. биохим, журн., т. 24, в. 2, с. 290, 1962, библиогр.;
Жоли М. Физическая химия денатурации белков, пер. с англ., М., 1968, библиогр.;
Птицын О. Б. Физические принципы самоорганизации белковых цепей, Усп. совр, биол., т. 69, в. 1, с. 26, 1970, библиогр.; Anfinsen С. В. The formation and stabilization of protein structure, Biochem. J., v. 128, p. 737, 1972, bibliogr.; Anfinsen G. B. a. Scheraga H. A. Experimental and theoretical aspects of protein folding, Advanc. Protein Chem., v. 29, p. 205, 1975, bibliogr.; Morawetz H. Rate of conformational transitions in biological macromolecules and their analogs, ibid., v. 26, p. 243, 1972, bibliogr.
В. А. Белицер.
Источник: Большая Медицинская Энциклопедия (БМЭ), под редакцией Петровского Б.В., 3-е издание
Рекомендуемые статьи
Источник
Денатурация белка – это процесс, который связан с нарушением вторичной, третичной, четвертичной структур молекулы под воздействием разных факторов.
Особенности процесса
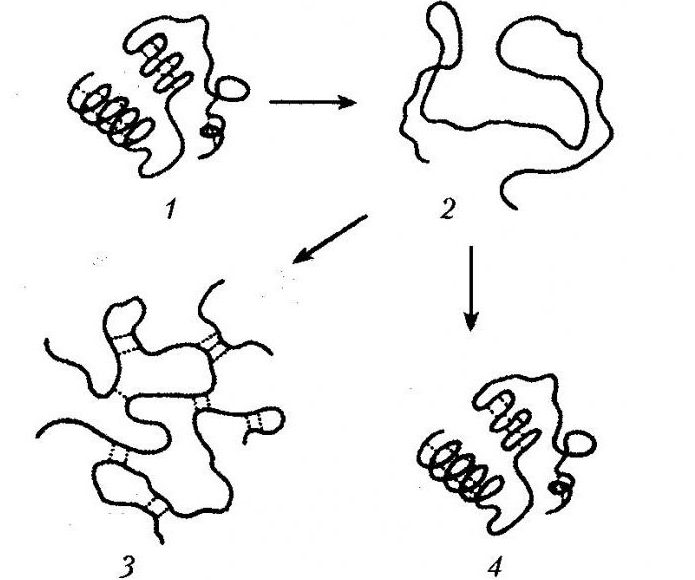
Он сопровождается разворачиванием полипептидной связи, которая в растворе изначально представлена в виде беспорядочного клубка.
Процесс денатурации белка сопровождается утрачиванием гидратной оболочки, выпадением белка в осадок, утрачиванием им нативных свойств.
Среди основных факторов, которые провоцируют процесс денатурации, выделим физические параметры: давление, температуру, механическое действие, ионизирующее и ультразвуковое излучение.
Денатурация белка происходит под воздействием органических растворителей, минеральных кислот, щелочей, солей тяжелых металлов, алкалоидов.

Виды
В биологии выделяют два варианта денатурации:
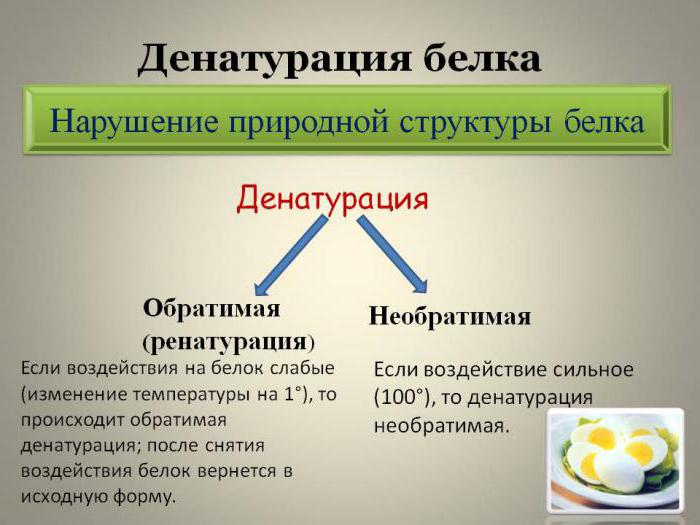
- Обратимая денатурация белка (ренатурация) предполагает процесс, в котором денатурированный белок после устранения всех денатурирующих веществ восстанавливается в исходную структуру. В этом случае в полном объеме возвращается биологическая активность.
- Необратимая денатурация предполагает полное разрушение молекулы, даже после удаления из раствора денатурирующих реагентов физиологичная активность не возвращается.
Особенности денатурированных белков
После того как произошла денатурация белка, он получает определенные свойства:
- В сравнении с нативной белковой молекулой увеличивается количество функциональных либо реактивных групп в молекуле.
- Уменьшается растворимость и процесс осаждения белков, чему способствует потеря водной оболочки. Происходит разворачивание структуры, появляются гидрофобные радикалы, наблюдается нейтрализация зарядов полярных фрагментов.
- Меняется конфигурация белковой молекулы.
- Утрачивается биологическая активность, причиной этого будет нарушение нативной структуры.
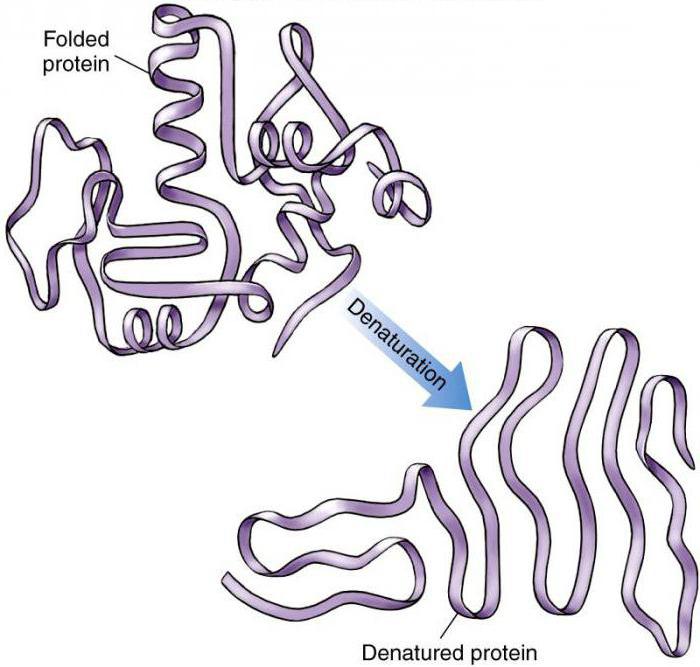
Последствия
После денатурации происходит переход нативной компактной структуры в рыхлую развернутую форму, упрощается проникновение к пептидным связям ферментов, необходимых для разрушения.
Конформация белковых молекул определяется возникновением достаточного количества связей между разными участками определенной полипептидной цепочки.
Белки, состоящие из достаточного количества атомов, которые находятся в непрерывном хаотичном движении, способствует определенным перемещениям частей полипептидной цепи, что вызывает нарушение общей структуры белков, снижение его физиологических функций.
Белки имеют конформационную лабильность, то есть предрасположенность к незначительным изменениям конформации, происходящим в результате обрыва одних и образования других связей.
Денатурация белка приводит к изменениям его химических свойств, способности вступать во взаимодействие с другими веществами. Наблюдается изменение пространственной структуры и участка, непосредственно контактирующего с иной молекулой, и всей конформацией в целом. Наблюдаемые конформационные изменения имеют значение для функционирования белков в живой клетке.
Механизм разрушения
Процесс денатурации белка предполагает разрушение химических (водородных, дисульфидных, электростатических) связей, стабилизирующих высшие уровни организации молекулы белка. В результате этого меняется пространственная структура белка. Во многих ситуациях не наблюдается разрушения его первичной структуры. Это дает возможность после раскручивания полипептидной цепи стихийно скручиваться протеину, создавая «случайный клубок». В подобной ситуации наблюдается переход к беспорядочному состоянию, имеющему существенные отличия от нативной конформации.
Заключение
Температура денатурации белков превышает 56 градусов Цельсия. Типичными признаками прохождения необратимой денатурации белковых молекул считаются снижение растворимости и гидрофильности молекул, повышение оптической активности, понижение стойкости белковых растворов, увеличение вязкости.
Денатурация вызывает агрегацию частиц, они могут выпадать в осадок. Если на белок действует денатурирующий агент на протяжении незначительного временного промежутка, высока вероятность восстановления нативной белковой структуры. Данные процессы широко используют при переработке продуктов питания, консервировании, изготовлении обуви, одежды, во время сушки фруктов и овощей. Денатурацию используют в ветеринарии, медицине, клинике, фармации, при проведении биохимических исследований, связанных с осаждением в биологическом материале протеина. Далее проводится идентификация в исследуемом растворе небелковых и низкомолекулярных инстанций, в результате чего можно установить количественное содержание веществ. В настоящее время ищут способы защиты белковых молекул от разрушения.
Источник
